Ο γραφίτης, μοριακός τύπος: C, μοριακό βάρος: 12,01, είναι μια μορφή στοιχείου άνθρακα, κάθε άτομο άνθρακα συνδέεται με τρία άλλα άτομα άνθρακα (διατεταγμένα σε κυψελοειδή εξάγωνα) για να σχηματίσει ένα ομοιοπολικό μόριο.Επειδή κάθε άτομο άνθρακα εκπέμπει ένα ηλεκτρόνιο, αυτά που μπορούν να κινούνται ελεύθερα, άρα ο γραφίτης είναι αγωγός.
Ο γραφίτης είναι ένα από τα πιο μαλακά ορυκτά και οι χρήσεις του περιλαμβάνουν την κατασκευή μολυβιών και λιπαντικών.Ο άνθρακας είναι ένα μη μεταλλικό στοιχείο που βρίσκεται στην ομάδα IVA του δεύτερου κύκλου του περιοδικού πίνακα.Ο γραφίτης σχηματίζεται σε υψηλές θερμοκρασίες.
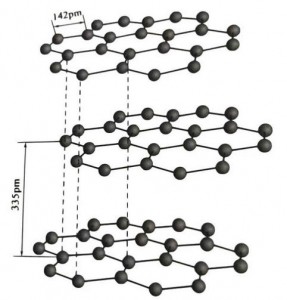
Ο γραφίτης είναι ένα κρυσταλλικό ορυκτό από στοιχεία άνθρακα και το κρυσταλλικό του πλέγμα είναι μια δομή με εξαγωνικά στρώματα.Η απόσταση μεταξύ κάθε στρώματος πλέγματος είναι 3,35 Α και η απόσταση των ατόμων άνθρακα στο ίδιο στρώμα πλέγματος είναι 1,42 Α.Πρόκειται για ένα εξαγωνικό κρυσταλλικό σύστημα με πλήρη στρωτή διάσπαση.Η επιφάνεια διάσπασης είναι κυρίως μοριακούς δεσμούς, λιγότερο ελκυστική για τα μόρια, επομένως ο φυσικός της πλωτήρας είναι πολύ καλός.
Στους κρυστάλλους γραφίτη, τα άτομα άνθρακα στο ίδιο στρώμα σχηματίζουν έναν ομοιοπολικό δεσμό με υβριδισμό sp2 και κάθε άτομο άνθρακα συνδέεται με τρία άλλα άτομα σε τρεις ομοιοπολικούς δεσμούς.Τα έξι άτομα άνθρακα σχηματίζουν έναν εξα-συνεχή δακτύλιο στο ίδιο επίπεδο, που εκτείνεται σε μια δομή ελασμάτων, όπου το μήκος δεσμού του δεσμού CC είναι 142pm, το οποίο είναι ακριβώς εντός του εύρους μήκους δεσμού του ατομικού κρυστάλλου, έτσι για το ίδιο στρώμα , είναι ατομικός κρύσταλλος.Τα άτομα άνθρακα στο ίδιο επίπεδο έχουν μία τροχιά p, η οποία επικαλύπτεται μεταξύ τους.Τα ηλεκτρόνια είναι σχετικά ελεύθερα, ισοδύναμα με τα ελεύθερα ηλεκτρόνια στα μέταλλα, επομένως ο γραφίτης μπορεί να μεταφέρει θερμότητα και ηλεκτρισμό, το οποίο είναι χαρακτηριστικό των μεταλλικών κρυστάλλων.Έτσι ταξινομούνται και ως μεταλλικοί κρύσταλλοι.
Το μεσαίο στρώμα κρυστάλλου γραφίτη χωρίζεται κατά 335 μ.μ. και η απόσταση είναι μεγάλη.Συνδυάζεται με τη δύναμη van der Waals, δηλαδή το στρώμα ανήκει στον μοριακό κρύσταλλο.Ωστόσο, επειδή η σύνδεση των ατόμων άνθρακα στο ίδιο επίπεδο στρώμα είναι πολύ ισχυρή και εξαιρετικά δύσκολο να καταστραφεί, το σημείο διάλυσης του γραφίτη είναι επίσης πολύ υψηλό και οι χημικές του ιδιότητες είναι σταθερές.
Λόγω του ειδικού τρόπου συγκόλλησης του, δεν μπορεί να θεωρηθεί ως ένας μόνο κρύσταλλος ή πολυκρύσταλλος, ο γραφίτης θεωρείται πλέον γενικά ως ένας μεικτός κρύσταλλος.
Ώρα δημοσίευσης: Ιουλ-31-2023